
技術文章
Technical articles 熱門搜索:
P760/01_2760nm單模垂直腔面發射激光器
VCSEL-20-M激光控制驅動器
ZNSP25.4-1IR拋光硫化鋅(ZnS)多光譜(透明)窗片 0.37-13.5um 25.4X1.0mm(晶體/棱鏡
HB-C0BFAS0832x4 QPSK C波段相干混頻器(信號解調/鎖相放大器等)
Frequad-W-CW DUV 單頻連續激光器 213nm 10mW Frequad-W
ER40-6/125截止波長1300nm 高摻雜EDF摻鉺光纖
SNA-4-FC-UPC日本精工法蘭FC/UPC(連接器/光纖束/光纜)
GD5210Y-2-2-TO46905nm 硅雪崩光電二極管 400-1100nm
WISTSense Point 緊湊型高精度光纖傳感器解調儀(信號解調/鎖相放大器等)
CO2激光光譜分析儀
1030nm超短脈沖種子激光器PS-PSL-1030
FLEX-BF裸光纖研磨機
NANOFIBER-400-9-SA干涉型單模微納光纖傳感器 1270-2000nm
高能激光光譜光束組合的光柵 (色散勻化片)
IRV2000-1X350-2000nm 1倍紅外觀察鏡
S+C+L波段 160nm可調諧帶通濾波器
熱門搜索:
P760/01_2760nm單模垂直腔面發射激光器
VCSEL-20-M激光控制驅動器
ZNSP25.4-1IR拋光硫化鋅(ZnS)多光譜(透明)窗片 0.37-13.5um 25.4X1.0mm(晶體/棱鏡
HB-C0BFAS0832x4 QPSK C波段相干混頻器(信號解調/鎖相放大器等)
Frequad-W-CW DUV 單頻連續激光器 213nm 10mW Frequad-W
ER40-6/125截止波長1300nm 高摻雜EDF摻鉺光纖
SNA-4-FC-UPC日本精工法蘭FC/UPC(連接器/光纖束/光纜)
GD5210Y-2-2-TO46905nm 硅雪崩光電二極管 400-1100nm
WISTSense Point 緊湊型高精度光纖傳感器解調儀(信號解調/鎖相放大器等)
CO2激光光譜分析儀
1030nm超短脈沖種子激光器PS-PSL-1030
FLEX-BF裸光纖研磨機
NANOFIBER-400-9-SA干涉型單模微納光纖傳感器 1270-2000nm
高能激光光譜光束組合的光柵 (色散勻化片)
IRV2000-1X350-2000nm 1倍紅外觀察鏡
S+C+L波段 160nm可調諧帶通濾波器
 更新時間:2025-11-04
更新時間:2025-11-04 點擊次數:21
點擊次數:21
一、背景介紹
光學技術具有非電離輻射、高分辨率、高對比度和對生物組織異變高度靈敏等特性,在生物醫學中扮演著越來越重要的角色,非常適用于生物組織的研究,包括成像、傳感、治療、刺激以及控制等等。然而由于生物組中光學折射率分布不均,光在生物組織中的傳播會受到很強的散射影響,導致了純光學技術的穿透深度和空間分辨率“魚和熊掌不可兼得";高分辨率光學成像應用僅限于樣品淺表層,當成像深度增加時分辨率急劇下降。如何實現光在深層生物組織里的高分辨率成像或應用,是人們期盼已久的目標。
香港理工大學賴溥祥教授課題組從光在生物組織中的傳播特性出發,綜述了領域內光-聲結合和光學波前整形等進展,以及相關技術在生物組織光學調控、成像、以及光學計算等方面的應用,并展望了發展趨勢。
二、深層生物組織光學技術方法
1、傳統光學方法
目前對于深層組織成像的傳統光學方法主要可劃分為三類:波長轉換、能量轉換、相位補償。波長轉換主要包括多光子熒光、上轉換等過程。多光子熒光的特點是目標分子在激發前同時吸收兩個或更多的光子,其相比于單光子成像具有更深的成像深度。能量轉換把輸入的光能量轉換成另一種形式的能量(如超聲),減少被探測信號的散射,從而提升成像的深度,如圖1所示,即為目前主要的各類光聲成像方式示意圖。
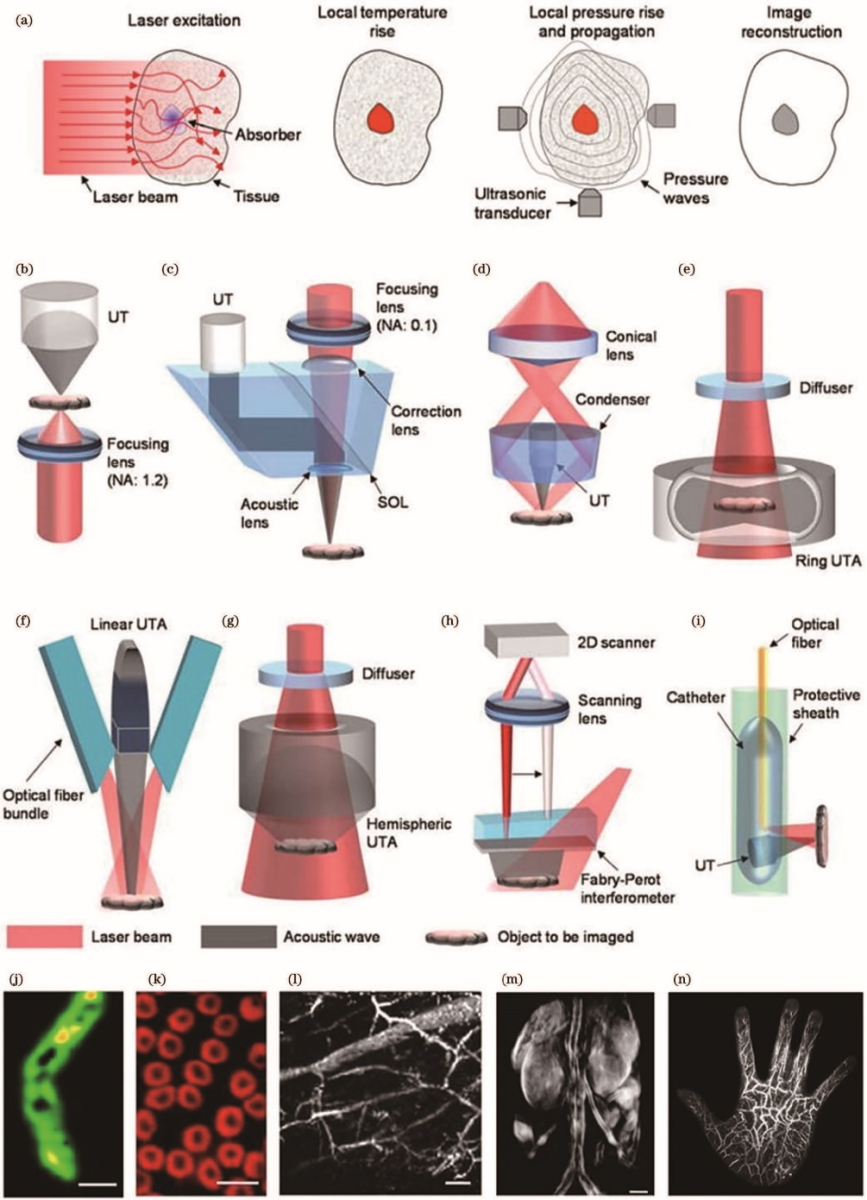
圖1 光聲成像原理及其代表實現形態,譬如光聲斷層掃描成像(PACT)、光聲顯微鏡(PAM)以及光聲內窺鏡(PAE)的示意圖
相位補償方法通過光學器件來測量和補償光學波前畸變,主要包括光學相位共軛(OPC)和直接自適應光學(AO)。OPC通過干涉記錄散射介質內部引導星位置散射光的相位分布,并利用相位共軛鏡對反方向傳播的入射光的波前進行共軛補償,重新使光聚焦到引導星位置,如圖2所示。AO通過測量并補償成像過程中的相位畸變,實現對光學系統的動態校正。AO有直接(使用波前傳感器測量相位畸變)和間接(使用軟件算法代替波前傳感器)兩種實現系統。
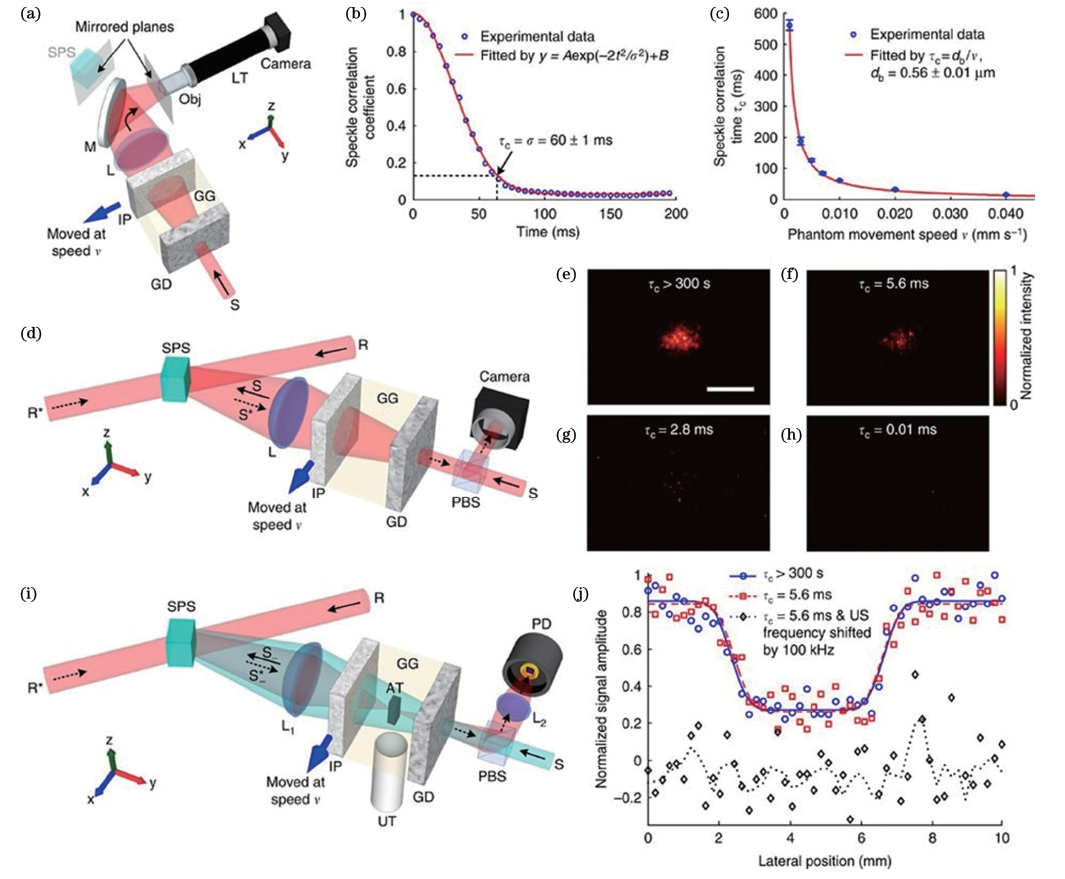
圖2 時間反演超聲編碼(TRUE)光學聚焦實驗
2、計算光學方法
(1)數字相位共軛(Digital optical phase conjugating,DOPC)
DOPC技術利用算法及空間光調制器(SLM)來實現相位共軛的技術,其基本物理原理與光學相位共軛相同,但不需要傳統OPC方法中的相位共軛鏡作為相位共軛鏡。DOPC對引導星位置的散射光進行全息測量并用相機記錄,用數字全息方法提取散射光相位并進行共軛操作,將計算所得共軛相位加載至SLM調制入射光波前,補償散射介質的相位畸變,在散射介質內部或后面聚焦,如圖3(a)~(d)所示實現在散射介質內部的光聚焦。
(2)迭代優化的波前整形(Iterative wavefront shaping,iWFS)
iWFS基于更簡單的光學系統,無需參考光路,根據反饋信號調整入射光波前的相位,并經過多次迭代后不斷提升焦點的亮度。反饋信號包括焦點處光強(Intensity)、聚焦對比度(PBR)、光聲信號[圖3 (e)~(f)]等多種形式。但聚焦前需要進行多次迭代優化,目前還很難實現生物組織中的實時聚焦。
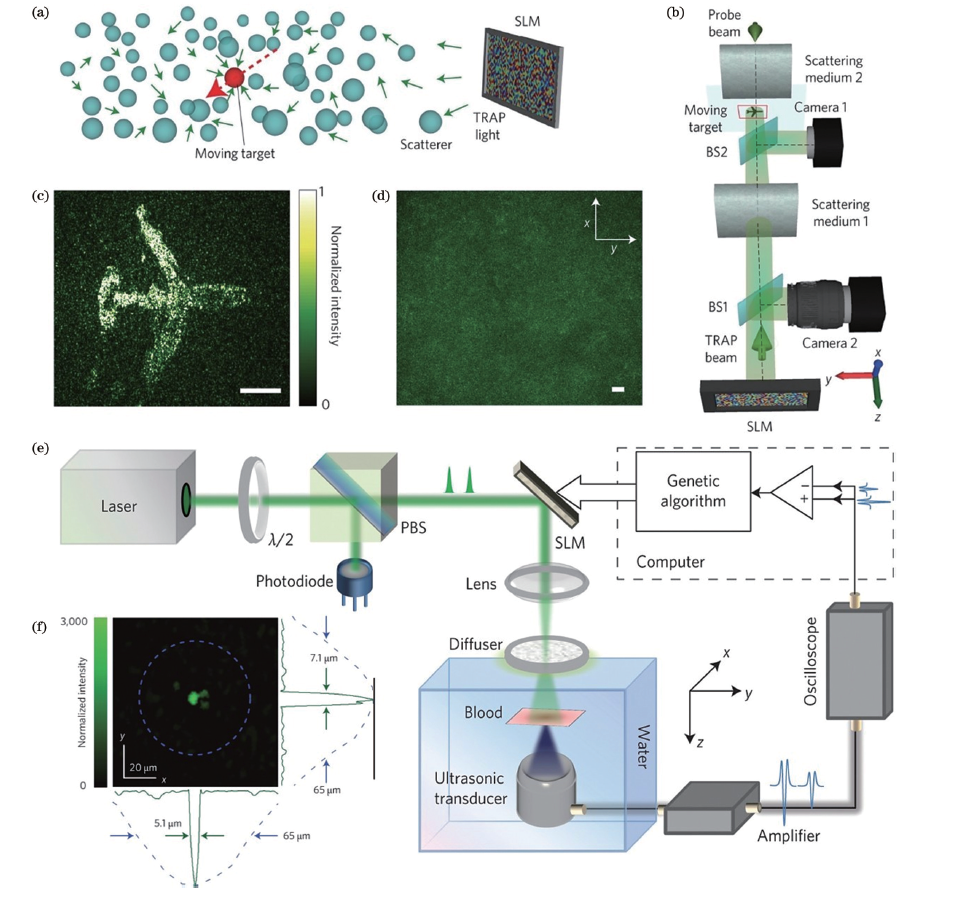
圖3 時間反演可控擾動[TRAP, (a)-(d)]與光聲引導波前整形[PAWS, (e)-(f)]
(3)傳輸矩陣方法(Transmission matrix,TM)
為實現實時成像,可預先推導出在空間不同位置實現在該點聚焦所需的對應波前補償圖案,從而實現快速光柵化掃描。在測量TM的過程中,需要向散射介質投射大量不同的調制光(如哈達瑪基,Hadamard basis)并記錄相應的輸出,由輸入和輸出光場之間的關系推算出TM,再通過矩陣逆運算推導出實現不同位置聚焦或圖案透射所需的補償波前。
(4)反射矩陣方法(Reflection matrix,RM)
傳輸矩陣TM的測量需要獲得透過深層生物組織的光反饋信號,因而難以用于無創深層生物組織。在實際應用中,我們可以通過無創方式,獲得反射或者背向散射的部分光信號,并根據反射光信號預測透射光信號,從而實現無創深層生物組織成像。
(5)自相關成像(Autocorrelation)
在散射介質中存在一個狹窄的范圍,輸出光場會隨著輸入光場的平移/傾斜而發生相應的平移/傾斜,即光學記憶效應(ME)。在ME范圍內,可以認為圖像自相關與散斑自相關近似相等。通過計算散斑的自相關,然后再使用相位恢復(PR)算法,即可重建原始圖像信息。
3、深度學習方法
近年來人工智能技術,尤其是深度學習(DL)算法的突破性發展,為解決散射介質和深層生物組織成像中的復雜問題提供了一個全新且強大的工具。DL 通過構建深層神經網絡(DNN)來學習并提取大量數據中的輸入與輸出關系之間的特征。在深層生物組織成像中,可以通過訓練DNN來構建輸入波前與輸出波前之間的映射關系,從而直接從散斑圖案中恢復原始圖像,不再需要進行聚焦和光柵化掃描,可有力簡化成像過程,提升成像速度。2022年,Zhao等提出基于光學散斑的加密系統(如圖4所示),將光學散斑作為信息加密載體,并設計了基于U-Net的DNN,實現了從光學散斑中恢復人臉,所恢復的人臉保真度高,可用于人臉識別等應用。
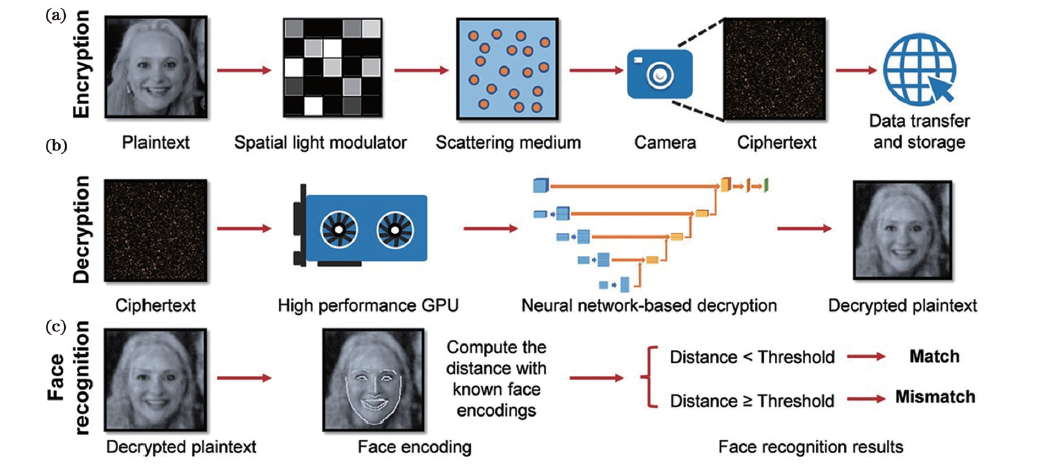
圖4 基于光學散斑的人臉識別加密系統流程圖。(a)加密:將明文(人臉圖像)加載到空間光調制器上,當激光穿過散射介質后,生成對應的密文散斑;(b)解密:將散斑輸入預訓練的神經網絡進行解密;(c)人臉識別:將解密圖像與已知人臉編碼進行對比
4、光纖介入方法
隨著光纖光學和光場調控技術的發展,基于光纖直徑小(約100~200 μm,相當于成年人頭發絲直徑)、可彎折、雙向光傳輸等特性,目前已有許多基于多芯光纖(MCF)實現光學內窺的相關研究和商業產品。同時,利用波前整形技術調控多模光纖(MMF)的輸出光場,使得基于單根多模光纖實現高分辨率內窺顯微成像成為可能。
(1)光纖熒光內窺鏡
MMF也可被視作一種散射介質,前面提到的克服光學散射進行成像的方法同樣適用于MMF成像。2010年Popoff等通過測定TM的方法實現了基于TM的單根多模光纖成像。2022年,Sun等提出了遠場散斑幅值轉換算法(FAST),并將其應用在定量相位成像(QPI)中,實現了通過無透鏡的超薄光纖束內窺鏡對凝膠微粒進行三維成像。2023年,Wen等提出了空間頻率域編碼追蹤自適應信標光場編碼方法(STABLE),并將其應用于單根MMF內窺鏡,展示了小鼠腸道的體內成像結果。
(2)光纖光聲內窺鏡
2022年,Liang等設計了一種基于光學外差超聲探測的光纖光聲內窺鏡,使用光纖傳導激發光到成像部位,并采用光纖超聲傳感器將超聲信號轉換為激光頻率變化,然后以光外差探測方式讀取光聲信號,如圖5所示。該光纖超聲傳感器具有尺寸小(探頭直徑僅2 mm)、靈敏度高、不受電磁干擾等優勢,適合深層生物組織中的超聲信號檢測。

圖5 光纖光聲內窺鏡及成像示意圖,(d)圖中比例尺為1 mm
5、基于光纖的光遺傳學
為避免傳統光遺傳學研究中的開顱手術,可以通過光纖將激光傳輸到特定目標區域,通過波前整形技術實現深層組織的高分辨率激活光敏蛋白質并記錄其產生的熒光信號,實現對特定細胞或組織的神經活動成像。2021年,Zhong等通過TM方法操縱MMF的輸出光場,并通過光柵化掃描實現腦區深層應用場景下對神經元的精準調控,如圖6所示。

圖6 基于多模光纖的精準光遺傳學調控
三、總結與展望
深層生物組織光學的發展前景廣闊,基于物理模型的傳統光學、計算光學、光纖光學與基于計算和數據驅動的深度學習相結合,各類方法對光學系統的成像深度、速度或者分辨率都有很大的提升,如表1所示。展望未來,不斷發展的深度學習與傳統光學、計算光學、光纖光學相結合,有望進一步促進深層生物組織光學研究的發展并推進其在生物醫學中的應用。
參考文獻: 中國光學期刊網
您好,可以免費咨詢技術客服[Daisy]
筱曉(上海)光子技術有限公司
歡迎大家給我們留言,私信我們會詳細解答,分享產品鏈接給您。
免責聲明:
資訊內容來源于互聯網,不代表本網站及新媒體平臺贊同其觀點和對其真實性負責。如對文、圖等版權問題存在異議的,請聯系我們將協調給予刪除處理。行業資訊僅供參考,不存在競爭的經濟利益。